نتایج فاز سوم کازآزمایی بالینی واکسن برکت دو سال پس از گرفتن مجوز در نشریه پزشکی «بیامجِی» منتشر شده است.
این مطالعه در شش شهر ایران از جمله تهران، بوشهر، اصفهان، مشهد، و شیراز با ۲۰ هزار شرکتکننده صورت گرفته است.
مقاله فاز سوم برکت، چهار بار مورد داوری قرار گرفته است و هر بار داوران نکاتی را مطرح کردهاند که به برخی پاسخ داده شده و شماری نیز پاسخ داده نشدهاند.
صدای آمریکا در گفتوگو با دو متخصص جزئیات این مقاله را مورد ارزیابی قرار داده است.
- جامعه آماری
میانگین سنی شرکتکنندگان در این مطالعه، ۳۸ سال و ۶ هزار و ۹۱۳ نفر از آنها زن بودهاند.
دکتر ماهان غفاری، محقق همهگیرشناسی و تکامل ویروس در دانشگاه آکسفورد بریتانیا، به صدای آمریکا گفت: «۱۸ شرکت کننده در آزمایش در سنین ۶۵-۷۵ سال بستری کووید و ۱ مورد بستری در آییسییو گزارش کردهاند. در حالی که بیشترین بحث مرگ ناشی از ابتلا به کووید-۱۹ در همین افراد بالای ۶۵ سال است.»
دکتر غفاری میگوید از همین رو، جمعیتی که «بیشتر برایمان مهم است تا اثر واکسن روی آنها را بسنجیم» در مطالعه گنجانده نشده است.
یکی از داوران مقاله نیز خواسته بود تا نتایج سنین بالا به صورت جداگانه محاسبه شود همانطور در مورد دیگر واکسنها برای ۶۰ سال به بالا که گروه هدف واکسن هستند محاسبه شده است.
از سوی دیگر اثربخشی واکسن برکت، ۵۰.۲ درصد برآورد شده است که به گفته دکتر غفاری، این واکسن، ۲ دهم درصد از آستانه تعیینشده توسط سازمان بهداشت جهانی بهتر عمل کرده است که آن را نیز نمیتوان به سنین بالا تعمیم داد.
- پیشگیری از مرگ
نویسندگان مقاله دو مورد مرگ در گروه دارونما گزارش دادهاند و میزان پیشگیری از مرگ توسط واکسن برکت، ۱۰۰ درصد عنوان شده است.
دکتر عنایت نیکوپور، متخصص ایمنیشناسی، در این رابطه به صدای آمریکا گفت: «در مجموع، ۵ نفر فوت کردهاند که ۳ نفر در گروه دارونما و ۲ نفر در گروه واکسن بودهاند.»
او در این باره میگوید: «سه نفر از فوتیها از مطالعه کنار گذاشته شدند چون مرگ بلافاصله پس از دز دوم بوده است. با این تعداد، نمیتوان ادعا کرد که پیشگیری از مرگ، ۱۰۰ درصد بوده است.»
- تغییر بازه زمانی و تاریخ کارآزمایی
در مقاله عنوان شده است که برای اندازهگیری کارآیی واکسن و برآورد ایمنی، افراد واکسینه شده به مدت ۹۰ روز تحت نظر بودند.
دکتر نیکوپور، متخصص ایمنیشناسی میگوید داورها در مورد عدم تطبیق مفاد پروتکل و نتایج از نویسندگان سوال کردهاند.
در پروتکل آمده است که افراد به مدت ۱۸۰ روز پس از دریافت دز دوم تحت نظر خواهند بود اما در مقاله آمار ۹۰ روز ارائه شده است.
به گفته دکتر نیکوپور «این طور به نظر میرسد که زمانی که دیدهاند کارآیی واکسن برای ۱۸۰ روز پایین بوده تصمیم گرفتهاند نتایج ۹۰ روز را ارائه کنند.»
در مقاله فاز سوم عنوان شده است که نخستین تزریق واکسن یا دارونما در تاریخ ۲۶ اردیبهشت ۱۴۰۰ در تهران انجام شد و آخرین تزریق واکسن یا دارونما در ۲۴ تیر ۱۴۰۰ در اصفهان صورت گرفت.
پیشتر، در مقالههای قبلی تاریخ شروع فاز سوم کارآزمایی واکسن برکت، روز ۲۶ خرداد عنوان شده بود.
- کارآیی واکسن
مقاله عنوان کرده است که از میان افراد واکسینهشدهای که در بازه زمانی مورد نظر به کووید-۱۹ مبتلا شدند، ۷۵۸ نفر (۵.۹ درصد) علائم داشتند، ۱۴۴ نفر (۱.۱ درصد) دچار ابتلای شدید شدند و هفت نفر (۰.۱ درصد) شرایط بحرانی پیدا کردند.
از شرکتکنندههایی که در این مدت، دارونما دریافت کردند، ۶۸۸ نفر (۱۰.۷ درصد) علائم داشتند، ۲۲۱ (۳.۴ درصد) دچار ابتلای شدید شدند و ۱۹ نفر (۰.۳ درصد) وضعیت بحرانی پیدا کردند.
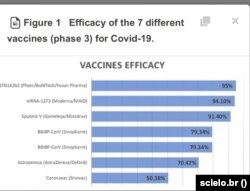
اثربخشی کلی واکسن، ۵۰.۲ درصد در برابر کووید علامتدار، ۷۰.۵ درصد در برابر بیماری شدید و ۸۳.۱ درصد در برابر شرایط بحرانی گزارش شده است.
دکتر نیکوپور میگوید کارآیی واکسن در برابر بیماری شدید، ۷۰ درصد ذکر شده که در مقایسه با سایر واکسنها که ۹۵ درصد به بالا بودهاند بسیار پایین است.
این رقم برای بیمار بستری شده در بخش مراقبتهای ویژه به ۸۳ درصد رسیده است که باز هم کمتر از دیگر واکسنها است.
- کمیت پاسخ ایمنی
آنتیبادیهای سرم در ۴۰۰ نفر پیش از تزریق و ۲ هفته پس از تزریق دز دوم واکسن اندازهگیری شده است.
دکتر نیکوپور میگوید: «در مجموع، میزان آنتی بادی تولیدی بسیار پایین بوده است.»
او توضیح داد که معمولا میزان آنتیبادی واکسن با آنتیبادی سرم افراد مبتلا به کرونا که بهبود یافتهاند مقایسه میشود تا برآورد درستی از قدرت خنثیسازی به دست آید و این میزان، باید بیشتر از سطح آنتی بادی گروه بهبود یافته باشد.
به گفته این متخصص ایمنیشناسی، در مطالعه دیگری از ایران، میزان آنتیبادی واکسن برکت از میزان آنتیبادی افرادی که کرونا داشتهاند کمتر بوده است. در همان مقاله، گزارش شده است که میزان آنتی بادی تولید شده توسط برکت کمتر از سایر واکسنها نظیر سینوفارم، استرازنکا، اسپوتنیک بوده است.
در مقاله «بیامجی» هم یکی از داورها پیشنهاد داده که با سایر واکسنها مقایسه بشود.
دکتر ماهان غفاری میگوید تا پایان موج دلتا، بیشتر استانهای ایران درگیر ویروس بودند و بالای ۶۰-۷۰ درصد مردم در معرض ویروس قرار داشتند بنابراین حتی اگر تست پیسیآر افراد منفی باشد، باید دید چطور از لحاظ سرولوژی (تست آنتیبادی) ابتلای زمینه را تفکیک و جدا کردهاند.
دکتر غفاری گفت مهم است که در داوری همتا، شرایط اپیدمیولوژیک (همهگیر شناسی) کشور را نیز مد نظر قرار داد.
- انتشار نتایج در مجلهای بینالمللی
متخصصان تأکید دارند که انتشار نتایج فاز سوم کارآزمایی بالینی در مجلهای شناختهشده به معنای مهر تأیید بر واکسن نیست چرا که مجلات در انتشار مقالهها جنبههای مختلفی از جمله تنوع مطلب و مدت زمان صرف شده روی داوری را پیش از تأیید و انتشار مد نظر قرار میدهند.
در آبان ۱۴۰۰ مقالهای در مورد نتایج آزمایشهای حیوانی واکسن برکت در یک نشریه تخصصی به نام «بازبینیها در ویروسشناسی پزشکی» (Reviews in Medical Virology) منتشر شد.
این مقاله که در بخش «سرمقاله» منتشر شده بود تعجب بسیاری را برانگیخت. در آن زمان، پرفسور پال گریفیتس سردبیر نشریه در گفتگو با صدای آمریکا گفت که مطالعات حیوانی واکسن برکت روند داوری همتا را طی کرده است، اما به این پرسش که چطور این مقاله تحقیقی ارزیابی شده و به مرحله انتشار در این نشریه رسیده پاسخ نداد.
پرفسور گریفیتس همچنین در پاسخ به این پرسش که چطور این مطلب برچسب «سرمقاله» دارد گفت: «اشتباهی از طرف ما پیش آمده است که برطرف خواهد شد.»
- نویسندگان مقاله فاز سوم
از نویسندگان مقاله فاز سوم برکت میتوان به مینو محرز، از مرکز تحقیقات ایدز ایران، اشاره کرد که به عنوان محقق اصلی با شفافارمد (زیرمجموعه گروه دارویی برکت) همکاری داشته و عضو ستاد ملی مبارزه با کرونا نیز بوده است.
اصغر عبدلی از دیگر نویسندگان مقاله است که مدیریت آزمایشگاه خصوصی ویروسشناسی امیرآباد را بر عهده دارد و بودجه این پروژه را تأمین کرده است بر خلاف اینکه گفته میشد ستاد اجرایی فرمان امام بودجه برکت را داده است. او همچنین عضو هیأت علمی انستیتو پاستور ایران است و در پروژه واکسن «پاستوکووک» نیز مشارکت داشته است.
پیام طبرسی نیز یکی دیگر از نویسندگان مقاله است که در پروژه واکسن «اسپایکوژن» نیز دخیل بوده است. او نیز عضو ستاد کلی مبارزه با کرونا بود.
- مجوز زودهنگام بدون مستندات لازم علمی
واکسن «کوو ایران برکت» پس از ممنوعیت واکسنهای غربی توسط علی خامنهای، نخستین واکسنی بود که در ایران مجوز استفاده اضطراری گرفت.
صدور زودهنگام این مجوز با انتقاد عدهای از پزشکان و متخصصان همراه شد. حتی کمیته ملی اخلاق در پژوهشهای پزشکی نیز پیش از صدور این مجوز، در نامهای به شیوه صدور مجوز اضطراری به واکسنهای تولید داخلی انتقاد کرده بود.
در این نامه تاکید شده بود صدور مجوز استفاده اضطراری تنها در صورتی قابل توجیه است که هیچ واکسن تایید شده و قابل تزریق دیگری در کشور موجود نباشد و چشمانداز واردات واکسن در کوتاه مدت نیز مبهم باشد.
مجوز استفاده اضطراری، در شرایطی صادر میشود که جان عده زیادی در خطر باشد و هیچ روش درمانی و یا پیشگیری تأییده شده دیگری نیز برای مقابله با بیماری موجود نباشد.
واکسن، علاوه بر اثربخشی، باید بیخطر باشد و برای اینکه بتواند واجد شرایط دریافت مجوز اضطراری شود، میبایست دستکم نیمی از شرکتکنندهها در آزمایشهای گسترده بر روی واکسن به مدت یک تا دو ماه پس از دریافت دز دوم - دوره زمانی که عوارض جانبی احتمالی ظاهر میشوند- تحت نظر باشند.
برای واکسنی مانند فایزر بیش از چهل هزار داوطلب در مطالعات فاز پایانی شرکت کردند و سازمان نظارت بر غذا و دارو، حدود یک ماه پس از ارائه نتایج مطالعات و ارزیابی آن توسط یک کمیته مستقل مشورتی، مجوز اضطراری استفاده از این واکسن را صادر کرد.
تعلل در واردات واکسن کرونا به دلیل تمرکز بر تولید داخلی، منجر به از دست رفتن جان هزاران نفر در ایران به دلیل ابتلا به کووید-۱۹ شد.
پژوهشگرانی از آمریکا، بریتانیا، استرالیا، و کانادا در پیشمقالهای که دکتر ماهان غفاری نیز از نویسندگان آن است نرخ واکسیناسیون کووید-۱۹ در ایران را با هفت کشور دیگر که از نظر نوع واکسن (غیرفعال)، سطح درآمد، یا جمعیت به ایران شباهت داشتهاند، مقایسه کرده و به این نتیجه رسیدند که تنها اگر واکسیناسیون در ایران، «سرعت» بیشتری میداشت از مرگ بین ۵۰ تا ۷۵ هزار نفر میتوانست پیشگیری شود.